纳米科学与工程学院纳米生物学实验室在调控肿瘤淋巴管增强药物递送领域取得重要进展

药物在肿瘤组织中的富集程度是决定其抗肿瘤效果的关键因素。长期以来,纳米药物被认为可以通过高渗透和长滞留(Enhanced permeability and retention, EPR)效应选择性的在肿瘤组织富集,实现对传统小分子化疗药物的“增效减毒”作用。然而,越来越多的临床数据表明,纳米药物相较于小分子化疗药物,并未显著提升抗肿瘤效果,其在实体瘤中的递送效率甚至非常低下。因此,开发增强瘤内药物富集的新策略对于纳米药物在临床上的成功应用至关重要,同时也对提升传统化疗药物的抗肿瘤疗效具有重要意义。当前多数研究集中于调控肿瘤血管或细胞外基质,但这些方法可能带来新的风险,如促进肿瘤细胞转移。因此,迫切需要探索更加安全可行的方法来增强肿瘤部位的药物富集。
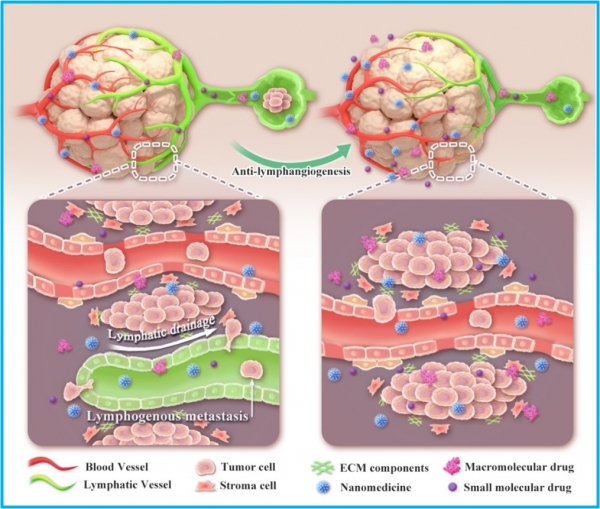
传统观点认为,肿瘤内部无功能性淋巴管,因此瘤内药物可以长时间滞留在肿瘤部位难以被排出。但是随着研究的不断深入,越来越多的证据表明,肿瘤微环境中确实存在功能性淋巴管,并且这些淋巴管在肿瘤的进展过程中扮演了非常重要的角色。加拿大多伦多大学的Warren C. W. Chan教授团队提出的ATR(Active transport and retention)原则,更是强调了肿瘤相关淋巴管在药物排出肿瘤组织中的重要作用。由于淋巴管是肿瘤转移的重要通道,抑制淋巴管新生已被证实是一种有效的抗肿瘤转移策略。
针对以上化疗药物和纳米药物面临的关键挑战,2024年4月15日,中国科学院大学纳米科学与工程学院张银龙副教授团队和国家纳米科学中心聂广军研究员团队联合在Signal Transduction and Targeted Therapy上发表题为“ Anti-lymphangiogenesis for boosting drug accumulation in tumors”的研究论文。
基于对肿瘤相关淋巴管功能的新认识,该研究团队提出:抑制肿瘤淋巴管生成的策略,在增强药物肿瘤部位富集效率的同时,有效抑制肿瘤细胞的转移。实验结果表明,瘤内药物可通过功能淋巴管排出肿瘤组织,使用抑制淋巴管生成的VEGFR-3抑制剂后,可显著提高小分子药物、生物大分子和纳米药物在肿瘤部位的富集。该工作还系统研究了所用抑制剂对肿瘤血管和肿瘤细胞外基质的影响,以排除其对药物富集带来的潜在增效作用。VEGFR-3抑制剂与游离药物Dox或纳米药物Lip-Dox联合使用,可以显著增强它们的抗肿瘤效果,并有效抑制肿瘤细胞的转移。总之,该工作提出了一种通用的增强治疗性药物在肿瘤部位富集的创新性策略,并显示出与当前主流治疗药物协同抗肿瘤的巨大潜能。
图:肿瘤淋巴管抑制策略增强药物瘤内滞留及抗肿瘤转移示意图
中国科学院大学纳米科学与工程学院张银龙副教授和国家纳米科学中心聂广军研究员为该论文共同通讯作者,国家纳米科学中心博士生王春岭为第一作者。该工作得到国家重点研发计划、中国科学院战略性先导研究计划、国家自然科学基金和中央高校基本科研专项资金等的资助。
原文链接:https://www.nature.com/articles/s41392-024-01794-4