水生所揭示母源因子Nanog通过翻译控制促进鱼类卵子发生和卵子质量的新机制

配子质量特别是卵子质量(卵质)是决定鱼类繁育成功和养殖效率的先决条件。鱼类的卵质由卵子中所储存的所有母源因子的集合所共同决定。开展母源因子对卵子发生和早期胚胎发育的调控研究可以指导鱼类卵质的评估,提升卵质,促进水产种业和养殖业的发展。在卵子发育和成熟的过程中,大量的母源mRNA被转录并囤积在卵子中,其在时空上有序的翻译激活或翻译抑制,即翻译控制(translational control),决定了卵子发生进程和卵子质量,甚至是受精胚的早期发育。已有的资料表明,母源mRNA在卵子发育的过程中需要受到严密的翻译控制。已报道的母源mRNA翻译控制的机制包括通过调控mRNA的poly(A)的长度,或通过特异的RNA结合蛋白序列特异性的抑制某些mRNA的翻译来实现。
12月19日,水生所孙永华研究员团队在国际学术期刊Development上发表了题为“母源Nanog通过翻译控制促进卵子发生和胚胎发育”的研究论文(Research Article),以斑马鱼为模型揭示了母源因子Nanog通过在全局水平调控母源mRNA的翻译控制从而促进卵子质量的新机制。该文被主编遴选为该期的研究亮点(Research Highlight),并配发题为“Nanog,不仅是一个多能性因子”的点评文章加以重点推荐。
图1 当期杂志以“Nanog,不仅是一个多能性因子”为题配发点评对孙永华团队论文进行重点推荐
在前期研究中,该团队利用斑马鱼模型,通过TALENs技术构建了重要母源因子Nanog的功能缺失突变体(He et al., Mutation Research, 2015),阐明了母源Nanog与TCF因子结合抑制母源β-catenin信号的全局性激活从而保护早期胚胎发育的新机制(He, et al, 2020, PLOS Biology)。然而,作为在卵子发生过程中即开始表达的重要母源基因(图2A),Nanog在卵子发生过程中的调控作用依然未知。通过对nanog母源突变体的表型进行分析,该团队发现缺失母源nanog导致早期胚胎严重败育,突变体的卵子成熟出现严重缺陷(图2)。
图2 缺失母源nanog导致卵子成熟和早期胚胎发育缺陷
进一步的蛋白组和转录组研究发现,突变体卵子中的翻译水平显著上调,翻译延伸因子eef1a1l2的转录水平显著升高。在nanog突变体中敲除eef1a1l2,双突变体的卵子中的翻译活性显著下调,卵子成熟缺陷得到明显改善;更重要的是,早期胚胎发育的缺陷也得到了显著的拯救(图3)。
图3 共敲除eef1a1l2可以拯救nanog突变体的卵子发生和早期胚胎发育缺
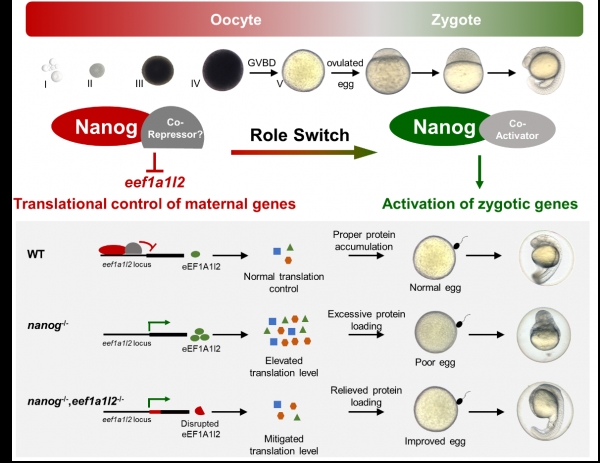
通过以上研究,该团队发现了母源因子Nanog通过对母源mRNA的翻译控制调控卵子发生和早期胚胎发育的新机制(图4):在野生型卵子中,Nanog通过结合在翻译延伸因子eef1a1l2的启动子抑制其转录,以确保卵子中的翻译活性处于正常水平,产生的卵子可正常受精并指导早期胚胎发育;在nanog突变体中,由于缺失了Nanog对eef1a1l2的转录抑制作用,eef1a1l2在卵子中异常激活转录,导致卵子发生的翻译机器异常激活,过量蛋白积累导致卵质变差,最终导致受精后的胚胎出现发育缺陷;当共敲除eef1a1l2之后,双突变卵子中的翻译机器恢复到正常水平,蛋白质表达过载得到缓解,卵质显著提升,早期胚胎发育的缺陷也得到显著的拯救。因此,该研究揭示了Nanog在卵子发生过程中作为转录抑制子抑制翻译延伸因子eef1a1l2的转录,从而在全局水平上对卵子发生过程进行翻译控制,促进卵子发生和早期胚胎的发育。
图4 Nanog通过eef1a1l2调控卵子发生和早期胚胎发育的分子模型
值得一提的是,与众多学者发现Nanog在合子基因激活时期扮演转录激活子的角色正好相反(Lee et al., Nature 2013; Veil et al., Genome Research 2019; Pálfy et al., PLOS Genetics 2020;Miao et al., Molecular Cell 2022),该研究发现Nanog在卵子发生的过程中扮演了转录抑制子的角色,提示Nanog作为一个先锋因子(pioneer factor)在卵子发生和胚胎发育过程中完成了从一个转录抑制子向转录激活子的角色转换(role switch)。
水生所何牡丹项目副研究员和博士生焦圣博为该文的共同第一作者,孙永华研究员为通讯作者,张茹博士、叶鼎副研究员及王厚鹏实验师等参与了该项工作。 这项研究得到国家杰出青年科学基金、国家自然科学基金面上项目等资助。文中所产生的突变体,已保藏至国家水生生物种质资源库国家斑马鱼资源中心。
文章链接: https://doi.org/10.1242/dev.201213
参考文献:
1,He, M., Zhang, R., Jiao, S., Zhang, F., Ye, D., Wang, H., Sun, Y., 2020. Nanog safeguards early embryogenesis against global activation of maternal β-catenin activity by interfering with TCF factors. PLOS Biology 18, e3000561.
2,He, M.D., Zhang, F.H., Wang, H.L., Wang, H.P., Zhu, Z.Y., Sun, Y.H., 2015. Efficient ligase 3-dependent microhomology-mediated end joining repair of DNA double-strand breaks in zebrafish embryos. Mutat Res 780, 86-96.
3,Lee, M.T., Bonneau, A.R., Takacs, C.M., Bazzini, A.A., DiVito, K.R., Fleming, E.S., Giraldez, A.J., 2013. Nanog, Pou5f1 and SoxB1 activate zygotic gene expression during the maternal-to-zygotic transition. Nature 503, 360-364.
4,Miao, L., Tang, Y., Bonneau, A.R., Chan, S.H., Kojima, M.L., Pownall, M.E., Vejnar, C.E., Gao, F., Krishnaswamy, S., Hendry, C.E., Giraldez, A.J., 2022. The landscape of pioneer factor activity reveals the mechanisms of chromatin reprogramming and genome activation. Mol Cell 82, 986-1002 e1009.
5,Palfy, M., Schulze, G., Valen, E., Vastenhouw, N.L., 2020. Chromatin accessibility established by Pou5f3, Sox19b and Nanog primes genes for activity during zebrafish genome activation. PLOS Genet 16, e1008546.
6,Veil, M., Yampolsky, L.Y., Gruning, B., Onichtchouk, D., 2019. Pou5f3, SoxB1, and Nanog remodel chromatin on high nucleosome affinity regions at zygotic genome activation. Genome Res 29, 383-395
责编 :张文静